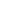Механизмы эпигенетики
Генетический код
Генетический код универсален и отличается чередованием нескольких нуклеотидов. Эти
самые «нуклеотиды», или полиморфизмы, определяют индивидуальные особенности
конкретного человека: то, как он выглядит, ведет себя в обществе, реагирует на стрессы и
т. д. Полиморфизмы задают своеобразный алгоритм изменчивости, способ реализации
которого зависит от эпигенетических факторов:
- питания
- стрессов
- вредных привычек
- сна
- инфекций
- экологии
- мыслей, визуализации

Генетика предполагает, а эпигенетика располагает
Эпигенетика исследует влияние указанных факторов на экспрессию генов. В большинстве случаев образ жизни определяет, проявится та или иная мутация или нет.
Геном можно сравнить с большим оркестром. От того, как «играют» его отдельные звенья, зависит общее звучание и восприятие музыкального произведения.
Так, недоедание, стресс во беременности меняет в худшую сторону концентрацию определенных гормонов в организме матери и плода (катехоламинов, инсулина, гормона роста), что нарушает функцию гипоталамо-гипофизарной системы, формирует склонность к ожирению, сахарному диабету II типа. Также реализуется обратная связь. Это доказывают опыты Р. Джиртла. Ученый вводил мышам ген «агути». Он кодирует сигнальную молекулу, одна из функций которой — регуляция окраски.
Такие мыши страдали от ожирения, приобретали ярко-рыжий окрас. Ученый доказал, что эпигенетические факторы способны обратить негативное действие мутации. Джиртлу удалось нормализовать состояние мышей путем введения в их рацион витаминов В9, В12, холина и метионина. Примечательно, что в последующем поколении ген «агути» не проявился. Все дело в эпигенетических метках (закладках). Этот механизм обеспечивает передачу эпигенетических изменений от поколения к поколению.
Еще одно наблюдение ученых отмечает, что у пожилых голландцев, чьи матери пережили голод в 1944-45 гг., была выражено снижена интенсивность метилирования гена инсулиноподобного фактора роста (ИФР- 1), из-за чего количество ИФР-1 в крови повышалось (фактор укорочения продолжительности жизни) (Ламбер Люмэ) И в следующем поколении дети, родившиеся в семьях этих голландцев, были маловесными и чаще других болели возрастными болезнями, хотя их родители жили вполне благополучно и хорошо питались.
Механизмы эпигенетики. Метилирование
Экспрессия генов регулируется несколькими эпигенетическими механизмами: метилирование, модификация гистонов, микроинтерфирирующие РНК.
Метилирование – самый значимый процесс. В момент метилирования метильные группы (СН3) присоединяются к цитозиновым основаниям, не разрушая и не меняя ДНК, но оказывая влияние на активность соответствующих генов. Присоединение метильных групп происходит с помощью специальных ферментов – цитозиновых метилтрансфераз.
Во время обратного процесса (деметилирования) метильные группы, наоборот, удаляются и активность генов восстанавливается. Метильные группы препятствуют контакту фактора транскрипции со специфическими участками ДНК, чем нарушают его синтез на рибосомах. Уровень метильных групп очень важен. Главный поставщик СН3 – фолатно-метиониновый цикл. Биологическая роль метилирования кроется в обеспечении клеточной дифференцировки.
Клеточная дифференцировка — «универсальные» эмбриональные клетки развиваются в специализированные клетки тканей и органов (эпителий, иммунные клетки, костная ткань, нервные клетки и др. появляются благодаря активности строго определенной части генома).
Инактивация Х-хромосомы у эмбриона
- инактивация X-хромосом у эмбриона девочек – для уравнения полов в количестве генных производимых продуктов (РНК и белков), большинство генов на одной из X-хромосом девочек выключается
- происходит на стадии бластоцисты (зародыш 50-100 клеток)
- в каждой клетке хромосома для инактивации (отцовская или материнская) выбирается случайным образом и остается неактивной во всех последующих генерациях этой клетки
Процесс метилирования участвует в патогенезе многих мультифакториальных заболеваний. Аутоимунные и воспалительные заболевания часто ассоциированы с нарушением регуляции Т-клеточных ответов, связанных с нарушением метилирования гена FOXP3. Рак груди может быть вызван гиперметилированием гена BRCA1. Инактивация метилцитозин-связывающего доменного белка 2 (MBD2), который участвует в подавлении транскрипции гиперметилированных генов, отмечена при онкологических заболеваниях.
Отдельно стоит сказать об инактивации Х-хромосом у девочек. Это происходит на стадии бластоцисты. В каждой клетке хромосома для инактивации выбирается случайно и остается неактивной во всех последующих генерациях этой клетки.
В последнее время нарушение процессов метилирования наблюдается у многих людей. Очень часто это связано с повсеместным использованием пластмассы – посуда, мебель и другие предметы быта. Бисфенол-А (отвердитель при изготовлении пластмасс) истощает метильный пул, угнетает метилтрансферазы, происходит сглаживание различий между полами и стимулирование рождения потомства с гомосексуальными наклонностями, нарушение метилирования генов, кодирующих рецепторы к эстрогенам (мыши-самцы рождались с характерным для самок поведением – покладистыми и спокойными)
Практическое значение
- регулярное употребление зеленого чая может снижать риск онкозаболеваний (эпигаллокатехин-3-галлат активизирует гены-супрессоры опухолевого роста (деметилирование)
- генистеин (продукты из сои) препятствует возрастному гипометилированию (профилактика возраст-ассоциированных заболеваний)
- 5-азацитидин ингибирует метилирование ДНК генов-супрессоров при раке кожи
- 1-й эпигенетический препарат, зарегистрированный в России – «Вайдаза» (вызывает реактивацию генов-онкосупрессоров, ингибируя DNMT; лечение гемобластозов)
- ингибирование метилирования ДНК и деацетилирования гистонов при миелодиспластическом синдроме (Kantarjian, et al., 2006), острой миелоидной лейкемии (Garcia-Manero et al., 2006) и Т-клеточной лимфоме (Duvic et al., 2007)
Эпигенетические часы
Понимание процесса метилирования имеет важное практическое значение. Зная, что и как влияет на синтез и присоединение СН3, можно управлять активностью соответствующих генов. Совокупность эпигенетических меток ДНК, или так называемые эпигенетические часы, позволяет установить биологический возраст ткани, клетки или органа. Наиболее известным примером таких «часов» являются часы Стива Хорвата, учитывающие 353 эпигенетических маркера человеческого генома. Описана связь хода эпигенетического времени с синдромом Дауна, ВИЧ-инфекцией, менопаузой, физической и когнитивной функциями.
• возраст, рассчитываемый по метилированию ДНК, предсказывает смертность от всех причин в пожилом возрасте, что позволяет предположить наличие связи между глобальным метилированием и причиной старения людей
• рост организма (и сопутствующее деление клеток) приводит к высокой скорости “хода” метилирования в течение первых 5 лет жизни, которая уменьшается до константного значения (линейной зависимости) к 20 годам (у стволовых максимальная скорость метилирования) и затем снижается
• средняя ошибка в определении возраста равна 3,6 года среди широко спектра тканей и типов клеток
• выявлено ускорение биологического возраста у женщин с раком молочной железы (Яков К. и соавт., J Natl Cancer Inst., 2019)
Определение эпигенетического старения по метилированию ДНК генов ITGA2B, ASPA и PDE4C позволяет определить биологический возраст человека со средним абсолютным отклонением от хронологического возраста не более 5 лет (точность выше, чем возрастные прогнозы на основе длины теломер).
Разные ткани и органы стареют с разной скоростью (медленнее всех головной мозг, быстрее всех – молочные железы у женщин)
*Сяоюй Ли, 2019 показал, что эпизоды нарушения ночного дыхания во сне у женщин предрасполагает к ускоренному старению (замедляют эпигенетические часы)
*Хорват С., 2014 – ожирение ускоряет эпигенетическое старение печени
В 2016 г. проведен масштабный мета-анализ (Стив Хорват), в котором были исследованы данные 13 089 человек из трех расовых/этнических групп: белых, латиноамериканцев и афроамериканцев.
Ускорение «эпигенетических часов» на 1 год (по сравнению с хронологическим возрастом) повышало риск смертности от всех причин до 4%. Причём, наблюдался и противоположный эффект: замедление хода «эпигенетических часов» приводило к понижению риска смертности.
*описана взаимосвязь хода эпигенетического времени с:
- физической и когнитивной функциями
- синдромами Дауна и Вернера
- ВИЧ-инфекцией
- болезнью Альцгеймера
- менопаузой
- долгожительством и замедлением хода «эпигенетических часов» на примере итальянских 100-летних долгожителей
На ход эпигенетических часов влияют следующие факторы:
Ускорение
- Повышение уровня инсулина, глюкозы, С- реактивного белка, триглицеридов в крови
- Избыточный вес
- Высокое артериальное давление
Замедление
- Рацион, богатый овощами, постным мясом и рыбой
- Умеренное употребление алкоголя
- Физическая активность
- Образование
Физическая нагрузка
• адекватные физические нагрузки замедляют ход эпигенетических часов
• во время нагрузки происходит синтез белка, влияющий на экспрессию генов (аутокринная
регуляция)
• 10000 шагов ежедневно доказано продлевают жизнь
Модификация и значение гистонов
Модификации гистонов основана на изменении химической структуры ядерных белков, упаковке участвующих ДНК. Гистоны участвуют в эпигенетической регуляции транскрипции, трансляции и репарации. Ядерные белки имеют N-концевой фрагмент из 20 аминокислот. Если на этот участок присоединяется какое-либо вещество, меняется структура гистона.
Значение модификации гистонов:
- регуляция экспрессии генов
- дифференцировка клеток
- регуляция процессов старения
- инактивация Х-хромосомы
- канцерогенез
- репарация ДНК
«Золинза» – ингибитор гистондеацетилаз, способствует ацетилированию гистонов, повышает активность генов онкосупрессоров и используется при лечении Т-клеточной лимфомы и других гемобластом.
МикроРНК
МикроРНК – это некодирующие молекулы РНК длиной 18-25 нуклеотидов. Если микроРНК присоединяется к матричной РНК, прекращается трансляция мРНК на рибосомах. Результат действия микроРНК идентичен «выключению» соответствующего гена. Этот механизм хорошо изучен в онкопатологии.
- результат действия малых микро РНК идентичен снижению экспрессии соответствующего гена
- важная часть механизмов противовирусной защиты и поддержания структуры хроматина
- онкология, хорея Гентингтона макулодистрофия
Эпигенетические болезни
Подходя к вопросу эпигенетических заболеваний, стоит сказать, что их не так много. В зависимости от локализации (масштабности) нарушений выделяют болезни как всего генома, так и отдельных его участков. Учитывая роль эпигенетической регуляции, этот уникальный инструмент в «умелых руках» может использоваться для профилактики и лечения мультифакториальных заболеваний – онкологии, сахарного диабета, бронхиальной астмы.
Нарушение эпигенетического статуса отдельных участков генома (локальный эффект)
- Болезни, обусловленные унаследованными мутациями, нарушающими моноаллельную экспрессию генов — болезни геномного импринтинга (синдромы Видемана-Беквита, Прадера-Вилли, Ангельмана)
- Болезни, обусловленные нарушенным статусом метилирования отдельных генов в результате de novo возникших мутаций в соматических клетках — а) раковые болезни, связанные с потерей импринтинга, приводящей к активации неактивного генов или подавлению экспрессии активного гена; б) раковые болезни, обусловленные гиперметилированием промоторов генов опухолевых супрессоров и их инактивацией
Нарушение эпигенетического статуса всего генома (глобальный эффект)
- Болезни, обусловленные унаследованными мутациями генов, продукты которых вовлечены в поддержание уровня метилирования ДНК или модификацию структуры хроматина — синдромы ICF, Ретта, ATR-X, Рубинштейна-Тейби, Коффина-Лоури
- Болезни, обусловленные глобальным нарушением метилирования генома в результате de novo возникших мутаций в соматических клетках— раковые болезни, связанные с глобальным гипометилированием генома, приводящим к активации онкогенов, ретротранспозонов и хромосомной нестабильности.

 2
2