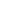- 1. Определение гипераммониемии
- 1.1. Косвенные признаки гипераммониемии
- 1.2. Механизмы токсичности аммиака
- 1.3. Причины повышения аммиака в крови
- 2. Цикл мочевинообразования
- 3. Нарушение транссульфации
- 4. Терапия
- 5. Аргинин
- 6. Цитруллин
- 7. Орнитин
- 8. SNP
- 9. Кетоз, кетоацидоз и кетонурия
- 9.1. Кетоновые тела
- 9.2. Механизм патогенеза
- 9.3. Ацетонемический синдром у детей
- 10. SNP
- 11. Диагностика
- 12. Лечение
Гипераммониемия и кетонурия
Определение гипераммониемии
Гипераммониемия – это метаболическое нарушение, вызванное избыточным количеством аммиака в крови. Аммиак является токсичным соединением, продуктом азотистого обмена, находящимся в крови в относительно небольших концентрациях (до 35 мкмоль/л).
Интересный факт: 80% аммиака синтезируется в кишечнике.
Косвенные признаки гипераммониемии
- резкий запах от тела, кала, мочи, стоп; «затхлый» запах от волос, периорбитальные тени;
- гипервозбудимость, агрессия/аутоагрессия, головная боль, слабость, повышенная утомляемость, сонливость, гиподинамия, кома;
- повышение глутамина в крови;
- гипопротеинемия на фоне повышения уровня мочевины в крови.
Механизмы токсичности аммиака
- связывание аммиака при синтезе глутамата вызывает истощение альфа-кетоглутарата из цикла трикарбоновых кислот (нарушение энергетического обмена);
- ионы аммония (NH4+) вызывают защелачивание плазмы крови – повышается сродство гемоглобина к кислороду (эффект Бора), в результате наступает клеточная гипоксия;
- накопление ионов аммония в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов (конкурирует с ионными насосами для Na+ и K+);
- продукт связывания аммиака с глутаминовой кислотой (глутамин) является осмотически активным веществом, возникает отёк тканей (причина отёка мозга при выраженной гипераммониемии).
Причины повышения аммиака в крови
- Нарушение в цикле мочевинообразования (первичные).
- Нарушение транссульфации.
- Дисбиоз – разрастание уреазопродуцентов Proteus mirablis, Klebsiella species, Escherichia coli, Morganella morganii, Providencia rettgeri, Corinobacteria, Mycobacterium genavense, Herpes simplex, Clostridia (Ghatak T, Azim A, Mahindra S, 2013).
- Патология печени (в том числе, прием препаратов – вальпроевая кислота, глицин, карбамазепин, рибавирин, сульфадиазин, пириметамин, салицилаты).
- Митохондриальная дисфункция.
- Дефицит ВН4 (тетрагидробиоптерина).
- Функциональные – высокобелковая диета, постстрессовая, спортивная (выраженные физические нагрузки).
- Употребление большого количества алкоголя и психоактивных наркотических веществ; выкуривание одной сигареты приводит к повышению уровня аммиака в крови на 10 мкмоль/л.
 Аммиак в крови
Аммиак в крови
Цикл мочевинообразования
Цикл мочевинообразования проходит в цитозоле и митохондриях. В процессе участвуют 3 аминокислоты – орнитин, аргинин, цитруллин. На долю мочевины приходится до 80-85% от всего выводимого из организма азота.
Функции цикла:
- превращение аммиака в мочевину;
- синтез аргинина и пополнение его депо в организме.
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Цикл мочевинообразования начинается с того, что ионы аммония, возникшие в результате окислительного дезаминирования глутаминовой кислоты, взаимодействуют с гидрокарбонат-анионом и АТФ при участии карбамоилфосфатсинтетазы, образуя карбамоилфосфат. В матриксе митохондрий карбамоилфосфат конденсируется с аминокислотой орнитином. Образующийся цитруллин переходит в цитозоль клеток печени, где и происходят остальные реакции цикла мочевины. В конечном итоге гидролиз аргинина, катализируемый аргиназой, приводит к образованию мочевины и регенерации орнитина.
Наследственные нарушения цикла мочевинообразования
- SLC7A7 – лизинурическая непереносимость белка.
- нарушен мембранный транспорт двухосновных аминокислот (орнитина, аргинина и лизина), что приводит к дефициту и нарушению их всасывания в желудочно-кишечном тракте и реабсорбции в почках.
- уровень аммиака при отказе от белковой пищи соответствует нормальным показателям, но значительно повышается после приема белковой пищи.
Нарушение транссульфации
Нарушение ТРАНССУЛЬФАЦИИ – вторичная гипераммониемия, НЕ связанная с нарушением мочевинообразования.
В процессе фолатно-метионинового цикла один из путей дальнейшего движения гомоцистеина связан с CBS-превращением в цистотионин, а затем в глутатион, таурин, токсичные сульфиты, которые с помощью SUOX превращаются в нетоксичные сульфаты. Аммиак является побочным продуктом процесса транссульфации. Если CBS работает адекватно (нет патологической гомозиготы), образуется физиологичный уровень аммиака, который идет на синтез аргинина, мочевины и не приводит к накоплению в крови.
Ускоренная работа CBS проявляется повышенным образованием аммиака. На этом этапе в процесс активно включается альфа-кетоглутарат. Он связывает аммиак и с помощью глутаматдегидрогиназы превращается в глутаминовую кислоту. Если глутаминсинтаза работает хорошо, процесс продолжается и образуется глутамин (высокая концентрация глутамина – диагностический признак гипераммониемии).
При нарушениях транссульфации необходимо:
- oграничить серные продукты и препараты;
- молибден (обезвреживание сульфитов);
- марганец, магний – кофакторы GS;
- юкка, бурбур пинелла, орнитин, цитруллин, аргинин;
- NADH (В3) – кофактор GLDH;
- не показан витамин В6.
Дефицит ВН4 (тетрагидробиоптерина) ведет к недостатку цитруллина и, как следствие, нарушению цикла обезвреживания аммиака.
Показаны:
- ВН4, маточное молочко, витамин С.
- Цитруллин.
- Умеренная физическая активность.
Нарушение микробиоты в сторону избыточного бактериального роста (СИБР) провоцирует повышенную выработку уреазы, под воздействием которой мочевина (активно) превращается в аммиак, вызывая тем самым симптомы гипераммониемии.
Proteus mirablis, Klebsiella species, Escherichia coli, Morganella morganii, Providencia rettgeri, Corinobacteria, Mycobacterium genavense, Herpes simplex, Clostridia
Чрезмерные физические нагрузки сопровождаются активацией процессов катаболизма. При распаде белков в мышцах происходят реакции трансаминирования аминокислот, образуется глутамат, который далее передает аминоазот на пируват с образованием аланина. Из мышц с кровью аланин переносится в печень, где в обратной реакции передает свою аминогруппу на глутамат. При перегрузках аланин истощается, что в свою очередь ведет к вторичному повышению аммиака в крови.
Терапия
- Низкобелковое питание.
- Аминокислоты цикла мочевинообразования (цитруллин (ОТС, CPS), орнитин, аргинин (кроме аргининемии)).
- Нутрицевтики для отвода аммиака – юкка, бурбур пинелла, альфа-кетоглутарат, карнитин.
- Коррекция микробиоты.
- Коррекция функции печени, почек.
Норма белка
- 1-3 года – 4 гр/кг/сут;
- 4-6 года – 4-3,5 гр/кг/сут;
- 7-10 лет – 3 гр/кг/сут;
- 11-13 лет – 2,2-2 гр/кг/сут;
- 14-17 лет – 2-1,5 гр/кг/сут;
- взрослые – 1,2 гр/кг/сут (силовые нагрузки 1,4-1,8).
Низкобелковая диета – снижение квоты белка на 50%
 Аргинин
Аргинин
Аргинин
Аргинин – условно незаменимая алифатическая аминокислота, существует в виде L- и D-изомеров. L-Аргинин входит в состав пептидов и белков.
Эффекты
- Сосудорасширяющий эффект (источник NO).
- Обезвреживание аммиака.
- Снижает уровень ЛПНП, не снижая уровень ЛПВП.
- Препятствует тромбообразованию.
- Стимулирует Т-клеточное звено иммунитета.
- При дефиците возможно мужское бесплодие.
- Улучшает потенцию.
- Способствует снижению веса, активизируя рост мышечной массы (стимулирует СТГ) и уменьшая объём жира (активизация бета-окисления жирных кислот).
- Нельзя принимать при активной герпетической инфекции.
- Предшественник – цитруллин.
Цитруллин
Цитруллин – аминокислота, которая не входит в состав строительных белков, однако имеет большое число физиологических эффектов (является промежуточным метаболитом в утилизации токсичного вещества – аммиака).
Эффекты
- Стимулирует иммунную систему.
- Участвует в цикле мочевинообразования.
- Связывает лактат и аммиак, восстанавливает запасы АТФ и креатинфосфата после тренировок.
- 50% цитруллина вызывает иммунный ответ у больных ревматоидным артритом.
- Усиливает синтез СТГ после тренировки.
Орнитин
Орнитин – важный промежуточный продукт на пути синтеза аргинина.
Эффекты
- Участник цикла обезвреживания аммиака.
- Стимулирует синтез СТГ.
- Стимулирует иммунную систему.
- Восстановление гепатоцитов.
- Стимулирует синтез инсулина.
SNP
- NOS – нарушение синтеза цитруллина.
- MTHFR 1298, CBS – фолатно-метиониновый цикл, транссульфация.
- GLDH (GDH) – глутаматдегидрогеназа (превращение альфа-кетоглутарата в глутамат).
- GS – глутаминсинтетаза (превращение глутамата в глутамин).
- SLC7A7 – лизинурическая непереносимость белка.
- CPS1 – карбамоилфосфатсинтетаза (гипераммониемия 1 типа).
- ОТС – орнитинтранскарбамоилаза (гипераммониемия 2 типа).
- ASS – аргининосукцинатсинтетаза (цитруллинемия 1 типа).
- СTLN2 – недостаточность цитрина, переносчик аспартат-глютамат (цитруллинемия 2 типа).
- ASL – аргининосукцинатлиаза (аргининосукцинатурия).
- ARG1 – аргиназа (гипераргининемия).
- SLC25A15 – переносчик орнитина в митохондриях, ННН-синдром (гиперорнитинемия, гипераммониемия, гомоцитруллинемия).
- NAGS – N ацетил глютамат синтетазная недостаточность.
- GGH – нарушение синтеза ВН4.
 Кетоз
Кетоз
Кетоз, кетоацидоз и кетонурия
Кетоз — физиологическое состояние в условиях дефицита глюкозы.
Кетоацидоз — патологическое состояние, при котором происходит сдвиг кислотно-щелочного баланса в кислую сторону.
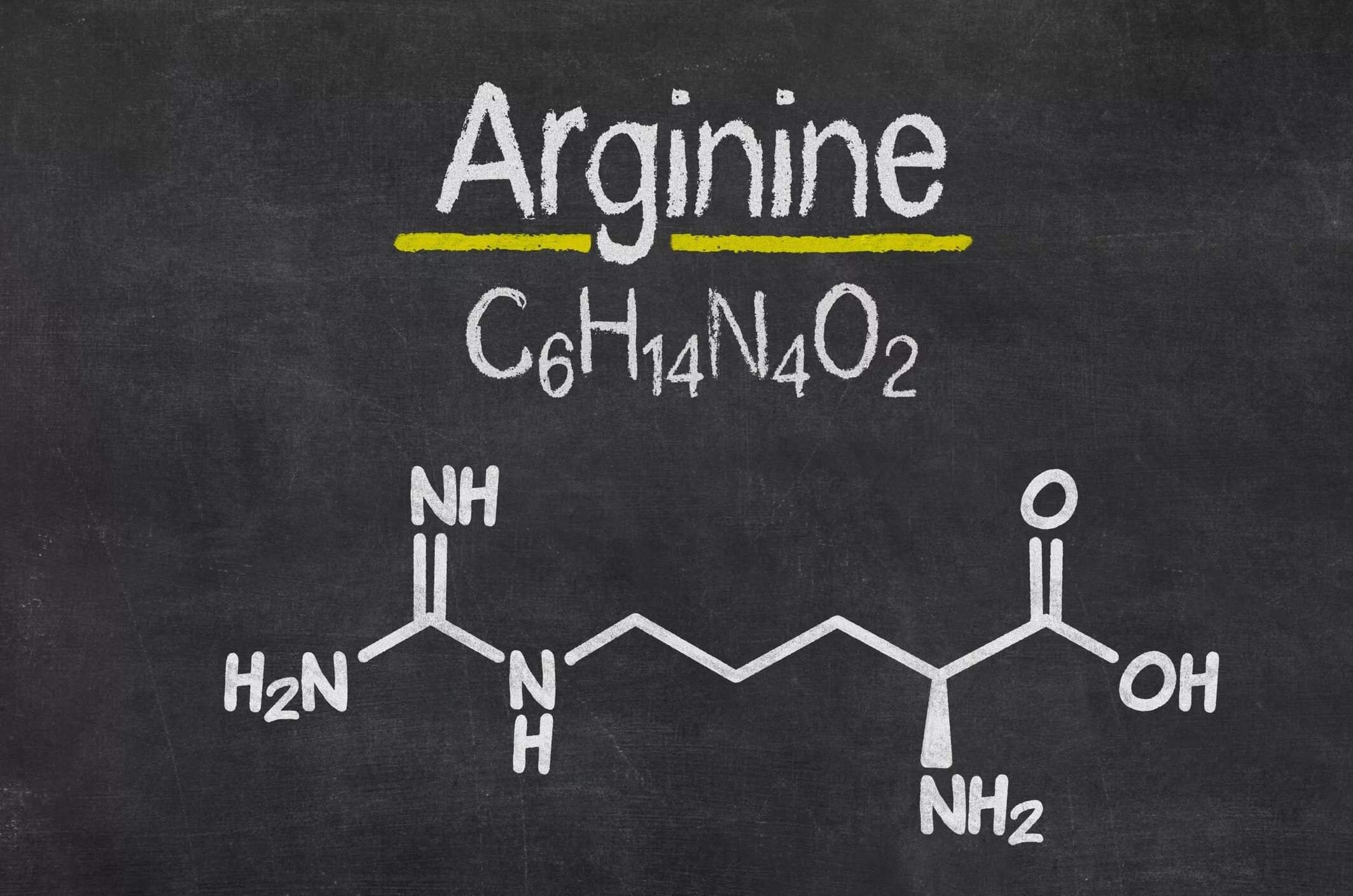
В состоянии кетоацидоза концентрация кетоновых тел повышается. Излишки выводятся с мочой (кетонурия или ацетонурия), через кожу и лёгкие. При голодании синтез кетоновых тел ускоряется в 60 раз, при сахарном диабете I типа – в 400 раз. У здоровых людей кетоновые тела в моче обнаруживаются в 1 % случаев. Норма ацетона в моче – до 0,5 ммоль/л
Кетоновые тела
Эффекты
- Образуются в печени в период голодания, при высокожировом питании, длительной физической активности, сахарном диабете - дают на выходе больше энергии.
- Стимулируют BDNF (нейротрофный фактор роста) – нейрогенез и митогенез.
При ГОЛОДАНИИ синтез кетоновых тел ускоряется в 60 раз, при сахарном диабете I типа – в 400 раз
Для того, чтобы «переключиться» с запасов гликогена необходимо либо 10-14 часов голода, либо 1 час бега через 4 часа после последнего приема пищи
Механизм патогенеза
- Ацидоза компенсируется гипервентиляцией, которая приводит к гипокапнии, вызывающей вазоконстрикцию, в том числе и церебральных сосудов.
- Излишек кетоновых тел оказывает наркотическое влияние на центральную нервную систему, вплоть до развития комы.
- Ацетон является жирорастворителем и повреждает липидный бислой клеточных мембран и миелин.
- Для утилизации кетоновых тел необходимо дополнительное количество кислорода – ГИПОКСИЯ.
- Избыток кетоновых тел раздражает слизистую оболочку желудочно-кишечного тракта, что приводит к рвоте и абдоминальному болевому синдрому.
 Патогенез
Патогенез
Дифференциация кетонурии
- Сахарный диабет.
- Длительная рвота (токсикоз).
- Дефицит углеводов в рационе, кетодиета.
- Гликогеноз.
- Нарушение пуринового обмена у детей.
- Абстинентный синдром при алкоголизме.
- Длительные физические нагрузки.
У здоровых людей кетоновые тела в моче обнаруживаются лишь примерно в 1 % случаев. Норма ацетона в моче – до 0,5 ммоль/л.
Ацетонемический синдром у детей
- Россия 4-6% детей, Австрия 2,3%, Шотландия 1,9 %
- Чаще АС регистрируется у девочек.
- Главный фактор – нарушение пуринового обмена (нервно-артритический диатез).
- Провоцирующие факторы – стресс, инфекция, низкоуглеводное и/или высокожировое питание, длительные перерывы в еде, обезвоживание.
SNP
- Дефицит GGPT (гипоксинтингуанилфосфорибозилтрансфераза) – синтез пуриновых оснований (гипоксантина и гуанина) и нуклеотидов (инозинмонофосфата и гуанозинмонофосфата).
- Дефицит UOX (уриказа) – превращение мочевой кислоты в более аллантоин.
- Гиперактивность PRPS1 (фосфорибозилпирофосфатсинтетаза) – катализирует процесс синтеза фосфорибозилпирофосфата из АТФ и рибозо-5-фосфата (Х-сцепленное рецессивное заболевание).
- Гиперактивность XO (ксантиноксидаза; кофактор молибден) – окисление гипоксантина в ксантин и мочевую кислоту.
Диагностика
- слабость, усталость, вялость, головокружение;
- жажда, сухость слизистой рта;
- тошнота, рвота;
- запах ацетона изо рта;
- умеренная гепатомегалия;
- интоксикация с повышением температуры до состояния выраженной лихорадки;
- обезвоживание;
- частое мочеиспускание;
- тахикардия;
- судороги, головная боль, рассеянность внимания.
Лечение
- Работа с основным заболеванием.
- Инфузионная терапия, усиленный питьевой режим, регидрон.
- Частое дробное питание, ограничение жиров, избегать дефицита углеводов.
- При нарушении обмена пуринов – ограничение продуктов с высоким содержанием пуринов.
- Сорбенты.
Таким образом, ГИПЕРММОНИЕМИЯ и КЕТОНУРИЯ – серьезные состояния, требующие адекватной коррекции с учетом индивидуальных особенностей организма (SNP) b последующим долгосрочным контролем состояния.

 2
2