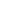- 1. Классификация старения
- 2. Биохимические признаки старения
- 3. Метилирование
- 4. Влияние на эпигенетические часы
- 5. Митохондрии
- 6. mTOR
- 6.1. Активаторы mTOR
- 6.2. Ингибиторы mTOR
- 7. ИФР-1
- 7.1. Активаторы ИФР-1
- 7.2. Ингибиторы ИФР-1
- 8. Аутофагия
- 9. Гликация
- 10. Воспаление
- 10.1. NAD+ и воспаление
- 11. Cенесцентные клетки
- 11.1. Сенолитики и сеностатики
- 12. FOXO (фактор транскрипции)
- 13. Репарация ДНК
- 13.1. Сон
- 14. Стратегия anti-aging
Anti-aging – антивозрастная медицина
Классификация старения
Антиэйджинг – раннее выявление, профилактика, лечение и уменьшение числа возрастных заболеваний. Цель – не только увеличение продолжительности жизни, но и улучшение её качества в старости.
В 2018 г. ВОЗ обновила классификацию возраста:
- 25−44 лет — молодой возраст;
- 44−60 лет — средний возраст;
- 60−75 лет — пожилой возраст (преклонный) возраст;
- 75-90 лет — старческий возраст;
- после 90 лет — долгожители.
Ученые из США, Испании и Норвегии провели сравнительное исследование скорости старения жителей 195 стран, проанализировав данные с 1990 по 2017 гг. Они выяснили, к какому возрасту в среднем у людей развивается несколько из 92 так называемых старческих болезней:
- инсульт;
- ишемическая болезнь сердца;
- гипертоническая болезнь;
- онкологические болезни;
- болезни Паркинсона и Альцгеймера;
- катаракта и глаукома;
- возрастное ухудшение слуха и др.
Степень влияния разных факторов: 15% - генетика важна, 15% - экология, 20% - здравоохранение, 50% - образ жизни и социально-экономические факторы.
Биохимические признаки старения
К биохимическим признакам старения относятся:
- нарушение процессов обновления;
- неспособность поддерживать постоянство внутренней среды организма;
- изменение количества клеток и качественного состава тканей, нарушение межклеточной сигнализации и активности систем ответа на стресс и метаболические изменения;
- хроническое воспаление, закисление;
- изменение регуляции метаболических путей (сигнальных);
- увеличение количества неспособных к делению клеток (сенесцентных);
- усиление образование активных форм кислорода в результате снижения активности митохондриальной дыхательной цепи и антиокислительных ферментов;
- запуск ответа на денатурацию белков в эндоплазматической сети, неспособность клеток утилизировать поврежденные белки и поддерживать протеостаз при помощи лизосом и протеасом (Tomaru et al., 2012);
- накопление поврежденных участков ДНК, генных и хромосомных мутаций, укорочение теломер, аккумуляция эпигенетических модификаций ДНК и гистонов, приводящих к перестройкам хроматина (А.А. Москалев, Е.Н. Прошкина, 2016).
*каждый день умирает 100000 чел от возраст-ассоциированных заболеваний.
Механизмы антиэйджинга:
- удлинение теломер;
- нормализация процессов метилирования;
- подавление хронического воспаления/закисления;
- поддержка митохондрий, минимизация образования активных форм кислорода;
- стимуляция аутофагии;
- устранение перекрестных сшивок белков (гликация);
- элиминация сенесцентных (не делящихся) клеток;
- восстановление уровней НАD+;
- ингибирование mTOR, ИФР-1;
- контролируемая активация генов «программы долгожительства» FOXO, AMPK, Klotho, NRF2.
 Метилирование
Метилирование
Метилирование
Особенности процесса метилирования:
- Эпигенетическое старение. Определение эпигенетического старения по метилированию ДНК генов ITGA2B, ASPA и PDE4C позволяет определить биологический возраст человека со средним абсолютным отклонением от хронологического возраста не более 5 лет. Эта точность выше, чем возрастные прогнозы на основе длины теломер.
- Рост организма. Рост организма (и сопутствующее деление клеток) приводит к высокой скорости “хода” метилирования в течение первых 5 лет жизни, которая уменьшается до константного значения (линейной зависимости) к 20 годам (у стволовых максимальная скорость метилирования) и затем снижается.
- Процесс старения. В процессе старения организма человека существенно снижается функциональный потенциал гемопоэтических стволовых клеток, что способствует развитию у пожилых людей кроветворной патофизиологии (причина – гиперметилирование ДНК генов, регулируемых репрессорных комплексом 2 белков Polycomb).
- Метилирование ДНК. Метилирование ДНК может способствовать здоровому старению человека, регулируя гены, восприимчивые к возрастным заболеваниям – при болезни Альцгеймера активно экспрессируется ген каспазы 3 (CASP3), которая участвует в расщеплении белка-предшественника бета-амилоида 4A, что ведёт к гибели нейронов, тогда как у долгожителей ген CASP3 заблокирован путём гиперметилирования участка вблизи от места инициации транскрипции этого гена. Рост организма (и сопутствующее деление клеток) приводит к высокой скорости “хода” метилирования в течение первых 5 лет жизни, которая уменьшается до константного значения (линейной зависимости) к 20 годам (у стволовых клеток максимальная скорость метилирования) и затем снижается. Ускорение «эпигенетических часов» на 1 год (по сравнению с хронологическим возрастом) повышает риск смертности от всех причин до 4%. Наблюдается и противоположный эффект: замедление хода «эпигенетических часов» приводит к снижению риска смертности.
Определение эпигенетического старения по метилированию ДНК генов ITGA2B, ASPA и PDE4C позволяет оценить биологический возраст человека со средним абсолютным отклонением от хронологического возраста не более 5 лет.
В процессе старения существенно снижается функциональный потенциал гемопоэтических стволовых клеток, что способствует развитию у пожилых людей кроветворной патофизиологии (причина – гиперметилирование ДНК генов, регулируемых репрессорных комплексом 2 белков Polycomb).
ДОКАЗАНО, что различные ткани и органы стареют с разной скоростью (медленнее стареет головной мозг, быстрее – молочные железы у женщин).
Влияние на эпигенетические часы
Ускорение:
- повышение уровня инсулина, глюкозы, С- реактивного белка, триглицеридов крови;
- повышенное артериальное давление;
- избыточный вес.
Замедление:
- умеренное потребление алкоголя;
- рацион с овощами, рыбой и постным мясом;
- физическая активность;
- образование.
Митохондрии
С возрастом снижается обеспечение клеток энергией, необходимой для процессов репарации и регенерации, увеличивается количество активных форм кислорода.
Ключевыми белками митохондрий, влияющими на продолжительность жизни и старение организма, являются TFAM (транскрипционный фактор, обеспечивает целостность мтДНК) и PGC1.
Медиатор биогенеза митохондрий (PGC1) является мишенью SIRT1, AMPK и играет ключевую роль в увеличении продолжительности жизни при ограничении потребления калорий. PGC1 способствует предотвращению дистрофических изменений при старении в скелетной мускулатуре, миокарде и жировой ткани.
Активные формы кислорода (АФК) – образуются во время работы I и III комплексов дыхательной цепи, особенно, при переизбытке субстрата и при старении (замедление их работы). АФК провоцируют мутации в мтДНК, негативно влияют на общий энергетический баланс организма.
 АФК
АФК
Для нейтрализации активных форм кислорода важно поддерживать активность SOD (супероксиддисмутаза).
Кофакторы SOD:
- медь,
- цинк,
- астаксантин,
- магний.
Ядерные рецепторы PPAR – активируются пероксисомными пролифераторами.
Эффекты:
- Регуляция транскрипции генов, отвечающих за метаболизм липидов и поддержание оптимального уровня глюкозы, чувствительность к инсулину и подавление хронического воспаления, сопровождающего старение.
- Индукция аутофагии, необходимой для поддержания клеточного гомеостаза.
- Поддержание оптимального уровня глюкозы.
- Подавление хронического воспаления.
- Активация PGC1 (основного модулятора биогенеза и работы митохондрий, регулятора окислительного фосфорилирования).
Теломераза – фермент, отвечающий за синтез высокоповторяемой теломерной ДНК, укорачивающейся при каждом делении зрелых соматических клеток. Теломераза состоит из 8-15 тыс. нуклеотидов (теломерные повторы TTAGGG), укорачивается на 30-150 нуклеотидов за одно деление.
Реактивация теломеразы позволяет сохранить длину неповрежденных участков теломер, что способствует увеличению репликативного и репаративного потенциала тканей. Укорочение теломер запускает сенесцентность (неспособность к делению) клетки (после 50-70 делений наступает смерть – предел Хейфлика).
Укорочению теломер способствуют:
- низкая физическая активность,
- курение,
- низкая стрессоустойчивость.
mTOR
mTORC1 активируется аминокислотами, белком на поверхности лизосом и осуществляет:
- регуляцию трансляции (активирует p70S6K, белок рибосом S6, фактор инициации трансляции eIF-4E и репрессирует ингибитор трансляции 4E-BP),
- биогенез рибосом (S6),
- подавление аутофагии (ингибирование ULK1),
- гликолиз (HIF-1),
- васкуляризацию (VEGF),
- синтез жирных кислот (SREBP1),
- ориентирует метаболизм клетки на дальнейший рост в зависимости от концентрации питательных веществ.
mTORC2 ингибирует транскрипционные факторы стресс-ответа FOXO1 и FOXO3, активирует фактор транскрипции NF-кB, провоцируя воспаление, канцерогенез и клеточное старение.
Подавление mTOR:
- повышает чувствительность к инсулину;
- уменьшает количество жировой ткани;
- активизирует митохондрии.
Активаторы mTOR
Активируют mTOR:
- тестостерон,
- высокобелковое, высококалорийное питание,
- лейцин, изолейцин, треонин и метионин,
- чрезмерная физическая нагрузка,
- орексин (нейромедиатор бодрствования, угнетается углеводами),
- ИФР-1,
- инсулин, лептин,
- омега-6,
- гормоны щитовидной железы,
- интерлейкин 6.
Ингибиторы mTOR
Ингибируют mTOR:
- ограничение белка в пище,
- интервальное питание,
- адекватная физическая нагрузка,
- ресвератрол,
- аспирин,
- генистеин (соя),
- крестоцветные,
- расторопша (силимарин),
- карнозин (аланин + гистидин),
- кофеин.
ИФР-1
ИФР-1 отвечает за интесификацию роста, а также метаболизма клеток, что само по себе предрасполагает к онкопроцессу, инсулино- и лептинорезистентности.
Активаторы ИФР-1
К активаторам ИФР-1 относятся:
- белковые продукты,
- корица, черника, соя,
- цинк, селен,
- карнитин,
- витамин С,
- ИФР-1,
- пролактин, СТГ (соматотропный гормон), ДГЭА (дегидроэпиандростерон), кортизол, эстрадиол,
- элеутерококк.
Ингибиторы ИФР-1
К ингибиторам ИФР-1 относятся:
- ограничение белковых продуктов, калорий, интервальное питание;
- адекватная физическая нагрузка;
- бобовые, куркума, томаты, арбуз, папайя, абрикос, грейпфрут, зеленый чай, орехи, изюм;
- куркумин;
- маточное молочко;
- глюкозамин.
Аутофагия
Аутофагия – процесс утилизации клеточных структур. Аутофагия важна для поддержания клеточного гомеостаза, регуляция которого нарушается при многих метаболических расстройствах, включая ожирение и резистентность к инсулину.
Стимуляторы аутофагии:
- Низкокалорийная диета с низким содержанием белка.
- Интервальное питание (у многих модельных организмов (от одноклеточных дрожжей до приматов) в многочисленных экспериментах выявлено положительное влияние на продолжительность жизни, массу тела, уровень заболеваемости постоянной низкокалорийной диеты (20-40% от суточной нормы)).
- Ресвератрол (красный виноград).
- Оливковое масло (один из механизмов, с помощью которого средиземноморская диета снижает риск онкопатологии).
- Масло CBD (каннабидиол) индуцирует аутофагию в эпителиальных клетках кишечника.
- Лития оротат, берберин.
- Уролитин А (образуется кишечной микрофлорой (Clostridium leptum) из сока гранатов, клубники, малины, красного вина).
- Физалин А (физалис).
- Диосцин (соя).
- Куркумин (приправа карри).
- Катехин, эпикатехин (зеленый чай, какао).
- 20-протопаноксатриол, магнофлорин (корень женьшеня).
- Гамма-токотриенол (бурый рис).
- Витамин B (белое мясо, хлеб, овес, бобовые, ячмень, шампиньоны, арахис, грецкий орех).
- Витамин Д.
 Гликация
Гликация
Гликация
Гликация – необратимый процесс неферментативных реакций между белком, сахарами и кислородом, который приводит к нарушению строения и функций белка.
В детоксикации конечных продуктов гликирования (AGEs) решающую роль играют:
- глиоксалазная система;
- активность рецепторов RAGE;
- зависимая от RAGE активация провоспалительного транскрипционного фактора NF-κB.
Связывание RAGE с их лигандами AGEs может запускать сигнальные пути, способствующие старению и развитию различных возрастных патологий, в частности ожирения, диабета II типа, аутоиммунных и нейродегенеративных заболеваний, хронического воспаления.
 Старение
Старение
Подавляют гликацию:
- ограничение простых углеводов;
- бенфотиамин;
- Р-5-Р;
- карнозин;
- коэнзим Q10;
- таурин;
- астаксантин;
- зеленый чай (+ стимулирует выработку коллагена);
- экстракт имбиря, душистого перца, корицы, гвоздики, шалфея, майорана и розмарина;
- альфа-липоевая кислота (активирует редуктазу, которая разрушает AGE).
Воспаление
Хроническая воспалительная реакция тканей организма является одной из известных причин старения/закисления. На клеточном уровне воспалительный ответ инициируют сигнальные пути, связанные с активностью транскрипционного фактора NF-κB.
NF-κB принимает участие в формировании иммунитета, регуляции синтеза цитокинов, факторов роста. Активация NF-κB инициирует экспрессию генов, участвующих в воспалении, антимикробных генов, а также повышает активность генов антиоксидантных ферментов, например SOD. С возрастом происходит повышение активности NF-κB, что приводит к хроническому воспалению, оксидативному стрессу и развитию возрастных заболеваний.
Сенесценция также является одной из причин воспалительного старения (inflammaging) за счет выбрасываемых сенесцентными клетками провоспалительных цитокинов.
Воспаление инициируют:
- ожирение;
- инсулинорезистентность;
- непереносимость нутриентов;
- очаги хронической инфекции;
Общий воспалительный фон снижают:
- куркумин;
- экстракт брокколи;
- босвеллия;
- мелатонин.
NAD+ и воспаление
Никотинамид (коферментная форма амида никотиновой кислоты) является предшественником динуклеотида аденина никотинамида NAD и играет существенную роль в повышении выживания клетки:
- Модулирует клеточный метаболизм, пластичность, воспалительную функцию клетки и удлиняет ее жизненный цикл.
- Увеличивает продолжительность жизни фибробластов (молодость коллагена).
- Поддерживает высокий уровень митохондриального мембранного потенциала.
- Активирует сиртуины.
Стимулируют NAD+:
- физические нагрузки;
- голодание;
- ограничение калорий;
- сауна;
- ресвератрол;
- литий;
- янтарная кислота;
- кора муравьиного дерева.
 Сенесценция
Сенесценция
Cенесцентные клетки
Сенесценция – это состояние клетки, для которого характерны длительная и необратимая остановка клеточного цикла.
Сенесцентные клетки влияют на соседние, активируют клетки иммунной системы, вызывают хроническое воспаление и запускают другие процессы за счет секретирования факторов SASP:
- Связывающихся с рецепторами: цитокины, хемокины и ростовые факторы.
- Прямого действия: матриксные металлопротеазы (ММР-1, ММР-10, ММР-3) и сериновые протеазы (тканевый активатор плазминогена (tPA) и урокиназный активатор плазминогена (uPA)).
- Выполняющих регуляторные функции: ингибиторы металлопротеаз (TIMP), ингибитор активатора плазминогена (PAI) и белки, связывающие инсулиноподобный фактор роста (IGFBP).
Некоторые из этих молекул являются постоянными составляющими SASP и используются в качестве маркеров сенесценции, например, IL-6 и IL-8. Постепенное накопление сенесцентных клеток в тканях ускоряет старение организма. Их количество в молодом организме регулируется иммуноклиренсом, способность к которому угасает с возрастом из-за старения иммунной системы. Существуют экспериментальные доказательства, что искусственная элиминация сенесцентных клеток приводит к замедлению развития возрастных патологий скелетных мышц, жировой ткани и увеличению продолжительности жизни животных.
Сенолитики и сеностатики
Особенности сенолитиков и сеностатиков:
- UBX0101 (сенолитик, ингибитор взаимодействия р53 (регулятор клеточного цикла) и MDM2) – II фаза клинических исследований.
- Комбинация из дазатиниба (противоопухолевый препарат) и кверцетина – I фаза клинических исследований.
- Физетин (полифенол) – II фаза клинических исследований; содержится в овощах и фруктах (огурцы, хурма, репчатый лук, яблоки, персики, киви, клубника).
- Куркумин (полифенол) – I фаза клинических исследований.
- Навитоклакс – ингибитор белков группы Bcl-2.
- Сероводород – повышение уровня H2S путем сокращения потребляемого с пищей метионина может оказаться легкодоступной стратегией снижения уровня сенесценции.
- Глюкорафанин (брокколи и кудрявая капуста).
- Токотриенолы.
- Пиперлонгумин (длинный перец).
- Нарингенин (грейпфрут).
- Кемпферол (каперсы).
- Ресвератрол (красное вино, клюква).
- Флороглюцин (водоросли).
- Гинзенозиды (женьшень).
- Олеуропеин (оливковое и аргановое масло).
- Спермидин (печень курицы, зеленый горошек, кукуруза).
FOXO (фактор транскрипции)
Сверхактивация FOXO связана с увеличением продолжительности жизни, стрессоустойчивостью модельных животных. Полиморфизмы в генах, кодирующих FOXO1a, FOXO3a у человека, ассоциированы с долголетием. Аллель G полиморфизма rs2802292 снижает старческую смертность, связанную с заболеваниями сердечно-сосудистой системы.
В стрессовых условиях FOXO индуцируется и вызывает экспрессию генов клеточной защиты:
- ген белка теплового шока Hsp70;
- ген репарации ДНК GADD45;
- гены аутофагии LC3B, Gabarapl1 и Atg12;
- лизосомальный ген Lamp1;
- гены убиквитин-протеасомного пути распада белков.
Активаторы FOXO:
- ресвератрол (виноград, клюква);
- кверцетин (каперсы, ягоды, брокколи, лук);
- лютеолин (морковь, капуста, артишоки, чай, сельдерей);
- куркумин;
- апигенин (сельдерей, лук, апельсины);
- зеленый чай.
Сиртуины – семейство никотинамид аденин динуклеотид NAD+-зависимых ферментов, обладающих деацетилазной и АДФ- рибозилтрансферазной активностью.
 Сирутин
Сирутин
С точки зрения детерминации долгожительства наибольший интерес представляют SIRT1:
- Активность SIRT1 увеличивается при нарастании внутриклеточного соотношения NAD+/NADH.
- Низкая активность связана с сахарным диабетом II типа, ожирением, нейродегенеративными расстройствами и раком.
- Регулирует апоптоз.
- Экспрессия SIRT1 уменьшает количество маркеров старения.
- SIRT6 стимулирует активность различных белков репарации ДНК в ответ на стресс.
- Снижают лептинорезистентность.
- Ингибируют mTOR и ИФР-1.
- Повышают чувствительность VDR к метаболитам витамина Д.
- Повышают чувствительность к эстрогенам.
В плане активации сиртуинов полезен гормезис – стимулирующее действие умеренных доз стрессоров; стимуляция какой-либо системы организма внешними воздействиями, имеющими силу, недостаточную для проявления вредных факторов (интенсивные упражнения, холод/тепло (обливания, сауна), учеба, умственная нагрузка).
Другие способы активации:
- никотинамида рибозид;
- интервальное питание, ограничение калорий;
- готу кола, кора муравьиного дерева;
- кверцетин, зеленый чай;
- цинк, куркумин, альфа-липоевая кислота;
- берберин, ресвератрол, физетин;
- витамин Д3;
- ликопин (томатный сок, гуава, помидоры, папайя, арбуз, розовый грейпфрут, хурма).
Klotho – мембранные корецепторы факторов роста фибробластов (FGF), которые регулируют уровень гормона роста, ИФР-1 и чувствительность тканей к инсулину.
При отключении гена Klotho у мышей появляются признаки ускоренного старения (остеопороз, атеросклероз, эмфизема легких и повреждения почек). Сверхэкспрессия гена Klotho увеличивает продолжительность жизни.
AMPK – клеточная протеинкиназа, контролирующая внутриклеточный энергетический баланс.
Фермент активируется при повышении соотношения АМФ/АТФ при голодании, нарушении митохондриального дыхания, гипоксии, обеспечивает утилизацию глюкозы, препятствует инсулинорезистентности.
Активаторы AMPK:
- низкокалорийное и интервальное питание;
- аэробные нагрузки;
- альфа-липоевая кислота;
- зеленый чай, куркумин, ресвератрол, кверцетин, берберин, цинк, карнитин, глюкозамин, креатин, коэнзим Q10, красный рис, грибы рейши, корица, оливковое масло, омега-3, соя, женьшень, яблочный уксус.
 ДНК
ДНК
Репарация ДНК
Многие синдромы ускоренного старения вызваны мутациями генов, кодирующих ферменты распознавания и репарации повреждений ДНК:
- синдром Вернера (ген WRN);
- пигментная ксеродерма;
- синдром Коккейна (ген CSA, CSB);
- атаксия-телеангиэктазия (ген ATM);
- синдром Секеля (ген ATR);
- синдром хромосомных поломок Ниймеген (ген NBS1).
Сон
Здоровый сон принципиально важен для адекватного функционирования организма, его недостаток влечет:
- изменение клеточного цикла;
- нестабильность генома;
- снижение активности теломераз;
- эпигенетические модификации различных генов;
- нарушение процесса протеостаза;
- митохондриальную дисфункцию;
- истощение пула стволовых клеток;
- нарушение межклеточной коммуникации;
- нарушение солевого обмена.
 Anti-aging
Anti-aging
Стратегия anti-aging
Для замедления старения рекомендовано:
- ограничение белка и простых углеводов;
- ограничение метионина, лейцина, изолейцина, валина, триптофана;
- ограничение калорий (PGC1, mTOR, ИФР-1, SIRT1 и AMPK);
- ощелачивающее питание;
- средиземноморский тип питания;
- оптимальный питьевой режим;
- физическая активность;
- сон;
- работа со стрессом, позитивное мышление;
- поддержание оптимального веса;
- активная мозговая деятельность, поддержание социальных связей;
- отказ от табака и курения;
- санация очагов инфекции;
- нутрицевтики.
Таким образом, антиэйджинг – перспективное направление медицины, призванное предотвратить развитие возраст-зависимых заболеваний и обеспечить активное долголетие, т. е. социально-экономическое, физическое и психологическое благополучие старшего поколения.

 2
2